В процессе исследования строения и свойств лигнина весьма важным является разрешение вопроса образования лигнина и других ароматических соединений в растении. Большинство исследователей в настоящее время считает, что исходными предшественниками лигнина являются производные кониферилового спирта. Такую гипотезу высказывали еще Класон [18°] и, несколько позднее, Эрдтман [181]. Однако долгое время оставались невыясненными вопросы образования кониферилового спирта и роли углеводов в этом процессе.
Манская представляет лигнификацию растительной оболочки как процесс окисления фенольных соединений, катализируемый оксидазами,. присутствующими в растительных тканях. Изучение биохимических превращений фенольных соединений в растениях, их участия в процессах ДЕ, гхания связано с именами Баха и Палладина.
Изучая окисление органических веществ в растениях за счет кислорода воды, Бах показал, что течение этой реакции должно зависеть от наличия соединений, выводящих освобождающийся водород из сферы реакции. Отсюда создалось представление об акцепторах водорода.
В ряде работ (1908—1919 гг.) Палладии показал, что в растениях широко распространены фенольные вещества, участвующие в процессе дыхания. Эти вещества им были названы «дыхательными хромогенами». При действии окислительных ферментов «дыхательные хромогены» образуют окрашенные хиноны — «дыхательные пигменты», которые, присоединяя водород, превращаются в исходные фенольные соединения. Учение Палладина о дыхательных хромогенах послужило основой для дальнейших исследований Опарина и других авторов.
Согласно представлениям, развитым Гиббертом [13°], катализаторами растительного дыхания являются вещества типа кониферилового спирта. Этот автор привел схему превращений катализаторов дыхания клеток на основе ароматических С6—С3-единиц. Схема сравнивалась им с С4-ди — карбоксильной кислотной окислительно-восстановительной системой Сцент-Дьерди для животной клетки
|
R—сн2—со—сн2он —2hf| + 2н р.—сн2—снон—сн2он 4—н2о R—сн=сн—сн2он |
|
2 |
|
‘-2" |
R’—сн2—со—r’ —2Н || — f 211 r’—сн2—снон—r’ 4—Н20 r’—сн=сн—r’
|
—2Н + 2Н r—сн2—сн2—сн2он (R = гваяцил или сирингил) Система С6—С3 |
—2Н Ц + 2Н r’—сн2—сн2—r’ (r’=cooh)
Система С,
По Гибберту, у высших и низших форм растений мономолекулярные пропилфенольные вещества синтезируются для выполнения функции дыхательных катализаторов — переносчиков водорода. У высших форы растений эти катализаторы окисляются, как предполагал Гибберт, в пост — мортальном состоянии и легко подвергаются сложной серии превращений (дегидрогенизации, конденсации и полимеризации), ведущих к образованию лигнина.
Манская [132′ ia4; 145] в течение последних лет опубликовала ряд работ по изучению процесса образования лигнина в растениях. С этой целью
|
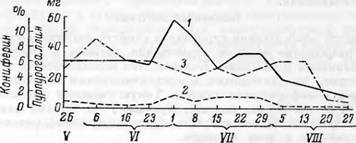
Дата отбора проб (1947г.) Рис. 147. Активность пероксидазы (в миллиграммах пурпуро — галлина на 1 г сухого вещества). |
1 — в прикамбиальном слое древесины; 2 — в камбиальном соке; з — Выход кониферина, в процентах к весу сухого вещества камбиального сока. (По Манской).
Проводилось исследование окислительных превращений глюкозида кониферина в камбиальной ткани, который является, по мнению Манской, исходным веществом при образовании лигнина.
О—СН—СНОН—СНОН—СНОН—CH—CH-OH
Ух)сн3 Сн=сн—сн2он
Кониферин
Манская выдвинула гипотезу, что образование лигннна связано •с нарушением дыхательной системы растений: в растительной ткани происходит необратимое окисление фенольных соединений под действием окислительных ферментов — фенолоксидазы и пероксидазы.
Еще в 1921 г. Палладии и Манская [131] установили присутствие фенол — ■оксидазы в древесине. Позднее Манская [132] показала, что камбиальная ткань сосны содержит пероксидазу и полифенолоксидазу. Согласно полученным ею результатам, наблюдается определенная зависимость между активностью окислительных ферментов и выходом кониферина из камбиального сока (рис. 147). В начале сезона (конец мая) наблюдается высокий выход кониферина и относительно небольшая активность ферментов {особенно пероксидазы), в середине лета происходит резкий подъем активности ферментов и снижение выхода кониферина. В августе активность окислительных ферментов падает, и выход кониферина снова увеличивается.
На основе проведенных исследований Манская пришла к выводу, что кониферин или его производные являются субстратом для окислительных ферментов. Манская предположила, что исходные фенольные соединения лигнина (кониферин, конифериловый спирт) являются, согласно Палладину, «дыхательными хромогенами» и участвуют в окислительно — восстановительных процессах в камбиальной ткани. Исходя из теории Опарина о превращениях фенольных соединений в живых и разрушенных клетках, Манская выдвинула положение, согласно которому в основе образования лигнина лежит процесс окислительной конденсации фенольных веществ в отмирающих древесных клетках. В этих клетках нарушено дыхание и окислительные процессы преобладают над восстановительными. По схеме, предложенной Манской, глюкозид кониферин, присутствующий в камбиальной ткани, гидролизуется |3-глюкозидазой с образованием глюкозы и кониферилового спирта
ОН
|
OC0HuOs |
|
Сн3о |
|
CHgO |
|
А |
|
+н2о |
|
+ с6н12о6 |
|
Глюкозидаза |
СН=СН—СН2ОН СН=СН—СН20Н
Кониферин Конифериловый спирт
Конифериловый спирт, окисляясь и восстанавливаясь, служит промежуточным звеном в цепи реакций, сопровождающих дыхание. Получающиеся при окислении кониферилового спирта (в присутствии оксидаз) лабильные продукты (вероятно, (3-оксиконифериловый спирт) при нарушении работы дыхательного аппарата превращаются путем дальнейшего уплотнения в лигнин, отлагаемый в клеточных стенках древесины. Эти процессы можно представить в виде схемы (схема № 2).
|
ОН I |
|
ОСИ, |
|
+о2 |
ОН
|
Окислительные ферменты |
|
V I СН—СН- <J—i |
|
-СН2ОН |
Конифериловый спирт
|
1- он |
|
Ферменты |
|
I ОН I |
|
Он |
|
‘ /ОСНз |
|
Оси, |
|
Оснч |
|
+Н2 |
СН2—СНОН—СН2ОН
|
Ферменты |
Р-Оксигидрокони — фериловый спирт
Сн2—СО—СН2ОН
Кетоформа (З-оксикониферило — вого спирта
V
СН=С(ОН)—сн2он
В-Оксиконифериловый спирт
"Уплотнение с i ванием лигнина Схема Ns 2
Известным подтверждением представлений об образовании лигнина из кониферина камбиального сока служат наблюдения Корчемкина [ш]. Автор заметил, что вещества свежесобранного сока сосны не дают качественной реакции на лигнин; при продолжительном же хранении сока в условиях, исключающих его брожение, из него выпадает осадок, дающий с солянокислым флороглюцином реакцию на лигнин.
В последнее время очень большое число экспериментальных исследований подтверждает значение кониферилового спирта в процессе образования лигнина. Манская и Бардинская [134] при воздействии на кони — фериловый спирт оксидаз из древеснеющих тканей получили окисленные полимерные соединения, имеющие максимум поглощения ультрафиолетового излучения при 285 и 260 тх.
Большого внимания по своей глубине заслуживают новейшие работы Фрейденберга и его сотрудников по биосинтезу лигнина из кониферилового спирта. Эти работы подошли очень близко к разъяснению вопроса о строении сложного вещества лигнина, в котором присутствуют сходные, но не вполне однородные С6—С3-единицы, конденсированные в более сложные комплексы.
Фрейденберг, так же как и Манская, считает, что конифериловый спирт превращается (полимеризуется) в лигнин под действием ферментов — дегидрогеназ, находящихся в камбии. Конифериловый спирт, в свою очередь, образуется из глюкозида кониферина, содержащегося в камбиальном соке. В лиственных породах, кроме кониферина, содержится глюкозид сирингин, продукт гидролитического расщепления которого — синапииовый спирт — также участвует в образовании лигнина (последний в отличие от продукта полимеризации кониферилового спирта содержит наряду с гваяцильными звеньями также сирингильные звенья)-
О—сн—снон—снон—снон—сн—сн2он он
‘——————— о—————— 1 сн3оч i. оси,
Ch3oxJ4/och3 YY
Ч 1
I
| сн=сн—Сн20н
Сн=сн—сн2он
Сирингин Синапиновый спирт
В подтверждение этим высказываниям Фрейденберг получил из кониферилового спирта «искусственный лигнин», так называемый DHP (Dehydropolymerisat). Автор показал, что если конифериловый спирт обработать в очень разбавленном растворе фенолредоксазой (восстановительно-окислительным ферментом, находящимся в соке шампиньонов Psalliota Campestris), с одновременной продувкой воздухом, то этот спирт превращается в светлый аморфный порошок, обнаруживающий свойства лигнина, но содержащий несколько большее количество двойных связей.
Превращение кониферилового спирта в «лигнин» проходит через промежуточную стадию, очень короткую по времени. В этой стадии образуется еще очень немного «лигнина» (х/5—1/3 часть от количества кониферилового спирта). Позднее наблюдается более полное выделение лигнина. В реакционной смеси удалось выделить и охарактеризовать следующие промежуточные соединения, составляющие около 75% от общего количества продуктов реакции [135J
СН2ОН
I
СН
II
Сн I
|
СН2ОН |
|
Сн. |
|
СН |
|
СН- I |
|
J |
I
О
Voch4
Дегидродиконифериловый спирт
|
Он I |
|
|
II V |
|
|
| |
|
|
Сн2 1 |
Сн 1 |
|
1 СН — 1 |
1 -сн |
|
1 СН |
Сн» |
|
ОСНч |
Rfl-Пинорезинол
СН2ОН
I
Сн
<?н I
I 3
СН-^О I
|
Гваяцилглицерин-Р-кони- фериловый эфир |
Сн I
У�СН3 ОН
В зависимости от условий смешения реагентов в смеси преобладал либо дегидродиконифериловый спирт, либо конифериловый эфир гваяцил — глицерина.
Фрейденберг считает эти продукты главными строительными звеньями лигнина. В отличие от кониферилового спирта он называет их вторичными звеньями. Все эти вторичные вещества, будучи отдельно смешаны с ферментом (фенолредоксазой), также переходят в нерастворимое подобное лигнину вещество. Хроматографические исследования [136] показали, что эти вещества присутствуют и в камбиальной ткани. Остальные 25% продуктов реакции содержат около восемнадцати различных веществ, из которых лишь немногие присутствуют в количестве около 2—3% [137]. Таким образом, по мнению Фрейденберга, лигнин хвойных является полимером дегидрированного кониферилового спирта.
Образование полимера и димерных продуктов Эрдтман [181> 138 ] и Фрейденберг объясняют сочетанием изомерных радикалов, образующихся из кониферилового спирта под действием дегидрирующих ферментов
Сн2он
I
![]()
|
/ХОСИ, |
|
V ocilo ЧЧхосн |
СН
I
|
СН2ОН I Сн L А |
|
СН2ОН I •сн I Сн II |
|
СН2ОН I СН |
|
СН2ОН I Сн Ли I •у�СН3 ОН |
Уосн3
ОН
Такие радикалы могут соединяться самым различным образом, давая чрезвычайно сложные цепи. Но расходятся взгляды Эрдтмана и Фрейденберга на механизм образования цепей лигнина из этих единиц. Эрдтман [138] предполагает, что в процессе
дегидрополимеризации кониферилового спирта в качестве промежуточных соединений получаются хинонметиды типа
|
К: Сщо |
|
/= V |
|
У~сн= |
|
=СН— СН2ОН |
|
=СН—СН—о- |
|
Сн*он осн3 |
Эти хинонметиды неустойчивы и стабилизируются путем дальнейшей димеризации, давая искусственный лигнин.
Фрейденберг [137] считает, что образование лигнина путем стабилизации хпнон — метидов за счет их дальнейшей димеризации маловероятно, так как в этом случае должны были бы образовываться нерастворимые продукты даже в начале полимери зации, чего в опытах Фрейденберга по энзиматическому дегидрированию раствора кониферилового спирта не наблюдалось. Осаждение искусственного лигнина начиналось лишь после израсходования большей части кониферилового спирта. Поэтому Фрейденберг приходит к заключению, что лигнин образуется путем непрерывной реакции — дегидрогенизационной конденсации. Получающиеся радикалы взаимодействуют друг с другом, образуя димеры, называемые Фрейденбергом вторичными структурными звеньями лигнина. Эти димеры, будучи фенольными соединениями, также подвергаются действию дегидрогеназ с образованием соответствующих радикалов, которые в свою очередь комбинируются далее с образованием более сложных структур.
Однако Фрейденберг допускает возможность образования из радикалов и хинон — метидов. Последние могут присоединять воду и давать |3-конифериловый эфир гваяцилглицерина. При проведении энзиматического дегидрирования кониферилового спирта в присутствии метанола Фрейденберг [165] получил а-метиловый-Р-конифериловый: эфир гваяцилглицерина. Его образование можно объяснить присоединением метанола к промежуточному хинонметиду
|
Сн2он 1 |
СН2ОН 1 |
|
1 Сн (1 |
1 Сн II |
|
Лн 1 |
II Сн 1 |
|
Сн2он у�СНз СН—- о I Сн II |
|
. сн2он^/� I I Сн—— о I СНОСНд I |
|
CHsOH |
В присутствии сорбита и сахарозы также образовывались соответствующие продукты присоединения. Фрейденберг предполагает, что подобным образом может осуществляться и связь лигнина с углеводами в растительной ткани.
Свои взгляды на близость процессов образования природного лигнина и лигнина, полученного энзиматической дегидрополимеризацией, Фрейденберг подкрепил результатами тщательного изучения свойств искусственного лигнина.
|
/осн3 |
При изучении искусственного лигнина сравнивалось его поведение в основных реакциях, характерных для природного лигнина. Искусственный лигнин, подобно природному лигнину, легко сульфируется. Реакция лигнина с бисульфитом является наиболее важной реакцией лигнина.
Многочисленные исследования показали, что при действии сернистой кислоты группа S03H в основном встает на место гидроксила замещенного — бензилового спирта. Подобный бензильный гидроксил имеется в свободном виде и в гваяцилглицерин-конифериловом эфире. Расщепляемые при варке с сернистой кислотой и бисульфитом (в более кислой среде) эфирные кислородные мостики имеются и в пинорезиноле (стр. 493), который также может освобождать свободные бензильные гидроксилы. Таким образом, по своему свойству сульфироваться, образовывать лигно — сульфоновые кислоты и переходить при этом в раствор искусственный Лигнин Фрейденберга подобен природному лигнину хвойных пород.
Если обработать природный лигнин сильной^минеральной кислотой, то отщепляется небольшое количество формальдегида. Оказывается, что искусственный лигнин также отщепляет в этих условиях формальдегид. Он образуется из первичных спиртовых групп дегидродикониферило — вого спирта и гваяцилглицеринкониферилового эфира. Как природный, так и искусственный лигнин дают красное окрашивание с солянокислым раствором флороглюцина. Искусственный лигнин, подобно природному лигнину, после обработки крепкой щелочью, метилирования и окисления дает несколько процентов изогемипиновой кислоты. Фрейденберг также производил эксперименты с синапиновым спиртом (см. стр. 492). Из одного синапинового спирта при помощи грибных ферментов не удалось получить искусственного лигнина. Если, однако, присутствует конифериловый спирт, то хорошо образуется полимерный продукт, [.содержащий максимально три единицы синапинового спирта на единицу кониферилового. Это явление находится в согласии с тем, что в природе никогда не встречаются лигнины, состоящие только из синапиновых производных.
Изложив здесь новые работы Фрейденберга по биосинтезу лигнина, нельзя не отметить сложность всех возникающих по этому поводу вопросов. Искусственный лигнин (DHP) Фрейденберга имеет много сходства с природным лигнином и наибюлее близким к нему лигнином Бьеркмана, но имеются и различия. Главные возражения [188], которые* были сделаны по поводу теории Фрейденберга, заключаются в подчеркивании трудности уподобления природного сложного процесса отложения лигнина искусственному и относительно упрощенному процессу дегидрополимеризации кониферилового спирта, проведенному вне живого организма.
Фрейденберг [139] и независимо от него Кратцль [14°] для доказательства превращения кониферина в лигнин путем биосинтеза провели серии опытов с меченым кониферином, содержащим радиоактивный углерод С14. Опыты отчетливо показали, что кониферин в живой растительной ткани превращается под влиянием ферментов в нерастворимые соединения, остающиеся фиксированными в тканях и не поддающиеся экстрагированию спиртом.
Из полученной радиоактивной древесины Кратцль при этанолизе получил активные мономеры Гибберта, в том числе, например, ванилоил —
Ацетил (ванилоилметилкетон)
НО—/ ^—СО—СО—СН3
У
Полученный ванилоилацетил имел меченый углерод в том же положении боковой цепи, что и исходный кониферин, т. е. не было обнаружено признаков какой-либо перегруппировки в фенилпронановом скелете при образовании лигнина из кониферина. Этими опытами было показано, что радиоактивный кониферин в растительной ткани действительно образует лигнин.
Несмотря на очень веские доводы, приводимые Фрейденбергом в оправдание предложенной им схемы образования лигнина, возникает естественный вопрос: является ли жонифериловый спирт единственным первоисточником лигнина или есть иные предшественники, которые своими путями биохимического синтеза формируют лигнин в растительной клетке. Зигель [141] исследовал 21 соединение на их способность образовывать лигнин в буферных растворах под действием пероксидазы и отметил значительное образование лигнина из соединений типа эвгенола
НО—^ СН2—СН=СН2
У, П Й
СИдО
При обсуждении этих вопросов на Четвертой международной конференции по биохимии, как сообщили Блэнд и Уордроп [142], Фрейденбергом были высказаны некоторые замечания. Он указал, что хотя при использовании Зйге? Лем фенолов (эвгенола или* изоэвгенола) и происходило введение этих веществ в ткань древесины вследствие присутствия ферментов, природный М??нин может формироваться только из тех веществ, которые действительно находятся в камбиальном соке. «Полимеризация» же’ ^эвгенола или изоэвгенола, по мнению Фрейденберга, не имеет ничего общего с образованием настоящего лигнина.
Работами >fte Адлера было показано, что эвгенол даже при стоянии может превращаться в конифериловый спирт, который и следует рассматривать, очевидно, в качестве предшественника лигнина.
Трэнар и Бариуа [143] нашли даже, что лигниноподобные вещества, отложенные в древесных тканях, культивированных на кониферине и сирингине, не являются по характеристикам Ах*ультрафиолетовых и инфракрасных спектров похожими на настоящий природный лигнин. Тем не менее Блэнд [142] правильно указывает, что отложение эвгенола и других фенолов в клеточных стенках представляет большой интерес для понимания типа и существа этих реакций.
Норд с сотрудниками [144] считает, что важнейшим соединением, принимающим участие в синтезе лигнина, является и n-оксикоричный спирт
НО—/ сн=сн—СН2ОН
Этот спирт может претерпевать метоксилирование. Хигучи с сотрудниками также показал, что конифериловый альдегид и тг-оксикоричныи альдегид под действием дегидрогеназы способны превращаться в соответствующие спирты, а последние —- в лигнин.
Природа предшественников лигнина непосредственно связана с биогенезисом ароматических веществ в растении. Первыми продуктами фотосинтеза в растениях являются цепи углеродных атомов — мономеры глюкозы, которые могут быть превращены в циклические соединения. Неизвестными оставались следующие стадии процесса — превращение циклических соединений в ароматические. В лабораториях подобные процессы удается осуществлять лишь с большим трудом. В растениях же ■синтез ароматических соединений, главным образом лигнина, совершается регулярно в жизненных процессах.
В последнее время в ряде исследований большое внимание уделяется шикимовой кислоте, по всей вероятности, участвующей в синтезе арома — тическцх соединенней широко распространенной в природе*’Шикимовая кислота близка по строен two к хинной кислоте, химические свойства которой и участие в обмене веществ у растений неоднократно изучались.
СООН НО СООН
НС сн2 Н2С сн2
TOC o "1-3" h z II II
Hoik : снон нон: снон
/ I
Сноп ггнон
Шикимовая кислота Хинная кислота
Работами Буткевича (1924 г.), Кизеля (1928—1930 гг.), Курсанова (1952 г.) было показано, что хинная кислота находится в генетической связи с глюкозой и в процессе обмена веществ является промежуточным звеном между углеводами и ароматическими соединекщшц.
Манская с сотрудниками [14Б] изучала распределение хинной и шикимовой кислот в молодых побегах и (лишках cocifti в процессе их развития и одревеснения с использованием метода, разработанного японскими авторами Ио&гда и Хаеегава. Проведенные исследования показали значительное содержание хинкод и шикимовой кислот в молодых побевах сосны (хиннвр до 5.23% от сухого веса, шикимовой — до 5.5%).’Их количество сначала нарастает (в период максимума айзнедёятельности растения), затем падает, когда побевт и шишки начинают одревесневать. Вероятно, хинная кйслота является более ранним продуктом фотосинтеза, затем под дотствием ферментов она превращается в шикимовую кислоту. Мерно предполагать, что хинная и шикимовая кислоты используются в растительных клетках для синтеза не толвко ароматических предшественников лигнина, но и других ароматических компонентов древесины.
Одновременно с изучением гидроароматических кислот Манская и сотрудники шроследили тайже изменение состава и процесс накопления ароматических альдегидов в сосновых побегах и шишках. Нитробензоль — пое’ окисление показало, что ароматические предшественники лигнина имеются уже на ранних стадиях роста. Кроме того, было обнаружено, что лигнин в формирующейся и зрелдревесине отличается не только по содержанию метоксильных групп и молекулярному весу, но и по составу получаюнтйхся из него ароматических альдегидов, и их количеству. При окислении молодых побегов обнаруживаются ванилин и /г-оксибензаль — д|гид, затем и-оксибензальдегид исчезает.
Большую помощь изучению химизма образования лигнина оказало исследование синтеза белков. Недавно были открыты бактерии,» которые могут синтезировать ароматические аминокислоты — фенилаланпн и тирозин. Дэвис [146]’ проследил некоторые ступени процесса их синтеза (см. схему № 3).
Линбхшая молекула глюяюзы сначала превращается в циклическое (не ароматическое) соединение, а затем, черезцесколько промежуточных стадий, в ароматическое соединение — фенилпировиноградную кислоту, которая является прямым предшественником ароматических аминокислот — фе — нилаланина и тирозина. Эти аминокислоты похожи на мономерные единицы лигнина тем, что у них имеется бензольное кольцо с боковой цепью из трех углеродных атомов. Норд и Шуберт [147] предположили, что процесс синтеза лигнина в растениях может походить на бактериальный синтез арома — 32 Н. И. Никитин
/И
Но—с—н
II—с—он I
Сн2он
D-Глкжоза
Соон
X
|
Но |
Н2с сн2
5-Дегидрохинная кислота
Соон
I
С сн2
Нс
0=с сион
5-Легидрошики- мовая кислота
СООН I
Нс сн2
I I
Нонс снон
Шикимовая кислота
Но сн2-
X
Нс сн
II II
Нс сн
|
-со—соон |
/ сион
Соон I
|
Сн |
|
НС I Нс |
|
Сн Сн |
|
^ / сн |
Нс
Нс сн
|
Соон I " Chnh2 I Сн2 |
^ / СН
СООН I
CHNHg I
СН2 I
УЧ
Ис сн
I II НС сн
|
Он Тирозин |
|
Префеновая кислота |
|
Фенилаланпн |
Фенилпировпно- градная кислота Схема 3
Тических аминокислот. Для проверки этого предположения проводились опыты [148] по введению радиоактивной шикимовой кислоты с изотопами углерода С14 (два в шестичленном кольце) в растущий сахарный тростник. Затем выделялся лигнин и окислялся нитробензолом и щелочью, в результате чего был получен радиоактивный ванилин с распределением активности углеродных атомов, соответствующим распределению в исходной шикимовой кислоте. Таким образом, неароматическое кольцо шикимовой кислоты превратилось в ароматическое кольцо лигнина. Подобными же экспериментами удалось установить, что в синтезе лигнина участвует и и-оксифенилпировиноградная кислота, которая, по мнению Норда и Шуберта, может быть непосредственным предшественником мономерных единиц лигнина. Во всяком случае, она стоит ближе к этим единицам, чем неароматическая шикимовая кислота. Было показано [149], что и-окси — фенилпировиноградная кислота, меченная радиоактивным углеродом в карбоксильной группе, может служить источником образования лигнина при введении ее в сахарный тростник. Меченый углерод оказывается в этом лигнине в положении С3 фенилпропановых единиц, т. е. на конце боковой цепи.
Норд и Шуберт дают следующую ориентировочную схему синтеза лигнина (см. схему № 4).
При сопоставлении различных данных Фрейденберг, Манская и другие исследователи приходят к выводу, что в синтезе мономерных структурных единиц лигнина большую роль могут играть аминокислоты, которые под действием соответствующих ферментов превращаются в спирты или кислоты — непосредственные предшественники лигнина.
TOC o "1-3" h z JI СООН
|
;СЧ СН2 110—С—Н НС сн |
?<R
О СООН со
II—с—он
Я ™
II—с—он НОНС СНОН НС сн
/
Н—С—он Снон с сн
I ^ /
I
-В-Глюкоза Шикимовая кислота п-Оксифенилпировино-
Градная кислота
Л. —L
~L ~L —L
-С — — С- -i.
—>
! 1L I II I II
НС СН НС с с с
W А / /
I С ОСН3 СН30 с осн3
Он он ‘ In
Мономерные единицы лигнина Схема № 4
По мнению Фрейденберга [137], ход образования лигнина в растущем еловом дереве следующий: шикимовая кислота ->префеновая кислота —> —> фенилаланин —> кониферин -» лигнин.
В опытах Фрейденберга [135] молодые растения ели использовали радиоактивный фенилаланин в построении радиоактивного лигнина. Подобные результаты с различными растениями получили Браун и Нейш [1ь0]. Они же поставили опыты с радиоактивным тирозином и также, в некоторых случаях, получили положительные результаты. По их мнению, в различных растениях при построении лигнина используются разные предшественники.
Бардинская [151] применила для исследования процесса биосинтеза лигнина метод культуры тканей. Она проводила исследование влияния кониферина и фенилаланина на лигнификацию тканей моркови. Срезы ткани моркови, которые показывают слабую лигнификацию даже в свеже — выросшем состоянии, культивировались в среде агар-агара с добавкой и без добавок кониферина и фенилаланина. На основании результатов своих опытов Бардинская приходит к заключению, что наряду с конифе — рпном в процессе одревеснения важную роль играют ароматические аминокислоты и, в частности, фенилаланин, что связано с известной общностью путей синтеза различных фенольных соединений в растительном организме.
Подобные исследования были также проведены Вачеком с сотрудниками [1S2J. Эти авторы изучали процесс лигнификации древесной ткани (ели). Ткань луба, не содержащая лигнина, после культивирования в среде
агар-агара с добавкой 1 % кониферина начинала давать сильное окрашивание с солянокислым раствором флороглюцина в свежевыросших участках. На добавку кониферина реагировала только живая ткань. После разрушения энзимов добавка кониферина уже не вызывала лигнификации.
Многие исследователи считают, что исходными веществами при построении растениями лигнина могут быть моносахариды. Экспериментальная проверка этой гипотезы была проведена Сергеевой и Крейцберг [153]. Эти авторы вводили в быстрорастущий тополь растворы радиоактивных пентоз, глюкозы и фруктозы. Из древесины был затем выделен серной кислотой лигнин; он оказался радиоактивным. При окислении древесины щелочным раствором нитробензола были получены радиоактивные ароматические альдегиды. Проведенные исследования позволили сделать вывод, что пентозы, глюкоза и фруктоза в процессе роста растительных тканей способны превращаться в ароматические соединения.
Еще ранее Нордом [154] была показана возможность превращения моноз в ароматические соединения. Для этого проводились опыты выращивания гриба бурой гнили Lentinus Lepideus в среде, содержащей глюкозу или ксилозу в качестве единственного источника углерода. При этом наблюдалось образование ароматического соединения — метилового эфира п-метоксикоричной кислоты
CIIsO—/ — С Г Г = С Г [—С О О С И3
Были определены многочисленные промежуточные продукты, в том числе седогептулоза,1 тг-оксифенилпировиноградная кислота и шикимовая кислота.
В настоящее время большинство исследователей предполагает, что синтез лигнина идет по следующей примерной схеме (схема № 5).
Заканчивая этим краткий обзор работ по химии лигнина, следует сказать, что за последние двадцать лет химические свойства, а отчасти строение и процесс образования этого вещества, получили в этих работах довольно большое и глубокое освещение. Последние два десятилетия дали нам характеристики строения отдельных мономеров, из которых построен лигнин. Были предложены новые методы осторожного расщепления лигнина и выделения из растительных тканей. В этот же период были даже проведены опыты синтеза искусственного лигнина из предположительно возможных его предшественников. На основании количественных определений тех или иных продуктов, получаемых при расщеплении лигнина, а также реакций с модельными соединениями были сделаны попытки выводов о возможном характере связей между отдельными мономерами в сложном и неоднородном веществе лигнина.
Применение новых физических методов исследования дает нам надежду на то, что в этом чрезвычайно сложном отделе органической химии в блшкайшие годы будет достигнута большая ясность.
Что касается практического использования лигнина, то, как уже выше говорилось, этот вопрос еще далеко не разрешен и мы знаем только
1 Седогептулоза
Н н н он I I I I
I I I I
Глюкоза
I
Седогептулоза
Г
Хинная кислота
Шикимовая кислота
I
1
Префеновая кислота
I
Фенилпировиноградная кислота
I
__________________ I___________________
I I
I I
/г-оксифенилпировиноградная фенилаланин
Кислота
I________
I I
I
Промежуточные тирозин————————————- ароматические
Кислоты метоксилированные кислоты
I
I I
первичные структурные единицы лигнина (конифериловый, синапиновый и ге-оксикоричный спирты)
Схема Ка 5
Частные случаи применения этого вещества. Есть, однако, надежда, что успехи в изучении строения и свойств лигнина, достигнутые в последние двадцать лет, продвинут в ближайшем будущем и этот вопрос — вопрос использования столь важного природного растительного сырья.

 Опубликовано в рубрике
Опубликовано в рубрике